Cérium a vitathatatlan „nagy testvér” a ritkaföldfémek nagy családjában. Először is, a ritkaföldfémek teljes mennyisége a kéregben 238 ppm, a cérium pedig 68 ppm, ami a teljes ritkaföldfém-összetétel 28%-át teszi ki, és az első helyen áll; másodszor, a cérium a második ritkaföldfém, amelyet kilenc évvel az ittrium felfedezése (1794) után fedeztek fel. Alkalmazása nagyon széleskörű, és a „cérium” megállíthatatlan.
A cérium elem felfedezése

Carl Auer von Welsbach
A cériumot 1803-ban fedezte fel és nevezte el a német Kloppers, a svéd vegyész, Jöns Jakob Berzelius és a svéd ásványtudós, Wilhelm Hisinger. Cériumnak, ércét pedig ceritnek nevezik, a Ceres, egy 1801-ben felfedezett aszteroida emlékére. Valójában ez a fajta cérium-szilikát egy hidratált só, amely 66-70% cériumot tartalmaz, míg a többi kalcium-, vas- és nitrogénvegyület.ittrium.
A cérium első felhasználási módja egy gáztüzelésű kandalló volt, amelyet Carl Auer von Welsbach osztrák vegyész talált fel. 1885-ben megkísérelte magnézium, lantán és ittrium-oxid keverékének előállítását, de ezek a keverékek sikertelenül zöld fényt bocsátottak ki.
1891-ben felfedezte, hogy a tiszta tórium-oxid jobb fényt ad, bár kék színű, és cérium(IV)-oxiddal keverve élénk fehér fényt kapott. Ezenkívül a cérium(IV)-oxid katalizátorként is használható a tórium-oxid égetéséhez.
Cérium fém

★ A cérium egy képlékeny és puha, ezüstfehér fém aktív tulajdonságokkal. Levegővel érintkezve oxidálódik, rozsdaszerű, hámló oxidréteget képezve. Melegítés hatására ég és gyorsan reagál vízzel. Egy centiméteres cériumfém minta körülbelül egy éven belül teljesen korrodálódik. Kerülje a levegővel, erős oxidálószerekkel, erős savakkal és halogénekkel való érintkezést.
★ A cérium főként monacitban és basztnezitben, valamint az urán, tórium és plutónium hasadási termékeiben található meg. Környezetre káros, különös figyelmet kell fordítani a víztestek szennyezésére.
★ A cérium a 26. leggyakoribb elem, a földkéreg 68 ppm-ét teszi ki, a réz (68 ppm) után a második leggyakoribb. A cérium nagyobb mennyiségben fordul elő, mint a közönséges fémek, például az ólom (13 ppm) és az ón (2,1 ppm).
Cérium elektronkonfiguráció
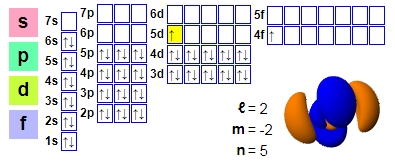
Elektronikus megoldások:
1p2 2p2 2p6 3p2 3p6 4p2 3d10 4p6 5p2 4d10 5p66p2 4f1 5d1
★ A cérium a lantán után található, és a cériumból kiindulva 4f elektronja van, ami megkönnyíti a kémiai reakciókban való részvételt. A cérium 5d pályája azonban foglalt, és ez a hatás a cériumban nem elég erős.
★ A legtöbb lantanida csak három elektront tud vegyértékelektronként használni, kivéve a cériumot, amelynek változó elektronszerkezete van. A 4f elektronok energiája majdnem megegyezik a fémállapotban delokalizált külső 5d és 6s elektronok energiájával, és csak kis mennyiségű energia szükséges ezen elektronikus energiaszintek relatív betöltésének megváltoztatásához, ami +3 és +4 kettős vegyértéket eredményez. A normál állapot +3 vegyérték, ami +4 vegyértéket mutat anaerob vízben.
Cérium alkalmazása

★ Ötvözet-adalékanyagként és cériumsók előállításához stb. használható.
★ Üvegadalékként használható az ultraibolya és infravörös sugarak elnyelésére, és széles körben használják autóüvegekben.
★ Kiváló környezetvédelmi anyagként használható, jelenleg a legreprezentatívabb az autóipari kipufogógáz-tisztító katalizátor, amely hatékonyan megakadályozza, hogy nagy mennyiségű autóipari kipufogógáz kerüljön a levegőbe.
★ Fényritkaföldfémekfőként cériumból álló növényi növekedésszabályozók, amelyek javíthatják a termésminőséget, növelhetik a terméshozamot és fokozhatják a növények stresszállóságát.
★ A cerium-szulfid helyettesítheti a környezetre és az emberre káros fémeket, például az ólmot és a kadmiumot a pigmentekben, színezheti a műanyagokat, valamint bevonatokban és tintagyártásban is felhasználható.
★Cérium(IV)-oxidpolírozóanyagként használható, például kémiai-mechanikai polírozáshoz (CMP).
★ A cérium felhasználható hidrogéntároló anyagként, termoelektromos anyagként, cérium-volfrám elektródként, kerámia kondenzátorként, piezoelektromos kerámiákként, cérium-szilícium-karbid csiszolóanyagokként, üzemanyagcella-alapanyagokként, benzinkatalizátorokként, állandó mágneses anyagokként, orvosi anyagokként, különféle ötvözött acélokként és színesfémekként is.
Közzététel ideje: 2023. július 3.